「プログラムの医療機器への該当性に関するガイドラインの一部改正について」および「プログラムの医療機器該当性判断事例」が公表されました!(2023年3月31日)
従来の薬事法が改正されて「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下、医薬品医療機器等法)」となり、2014年11月25日に施行されました。
従来はソフトウェア部分のみでは薬事法の規制対象とならず、ハードウェア部分に組み込んだ形で規制していましたが、この法律では、ソフトウェアを単体で流通することを可能とし、「医療機器プログラム」として規制対象とすることとなりました。
本サイトでは、医薬品医療機器等法の規制対象となるプログラムはどのようなものか、規制対象となったプログラムはどのような手続きが必要かなどについて簡単に説明します。
なお、新しい情報が追加され次第、このサイトで情報提供していきます。
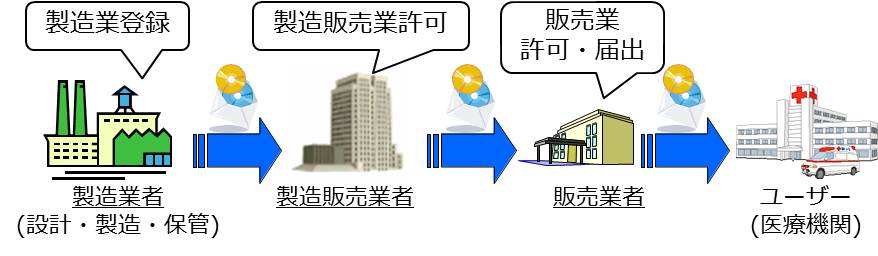
CD-ROM等のメディア販売を行う場合のモノの流れ